Chers amis de la santé,
Je tiens à partager avec vous des avancées scientifiques de premier plan qui illustrent à quel point notre compréhension des liens entre le microbiote intestinal et la santé humaine ne cesse de progresser. Ces découvertes renforcent notre conviction que la médecine du futur sera résolument personnalisée, prenant en compte les spécificités de chaque individu, notamment son microbiote fortement dépendant de ses habitudes alimentaires, pour adapter les traitements et maximiser leur efficacité.
L’immunothérapie, cette révolution thérapeutique dans le domaine du cancer, a montré des résultats spectaculaires chez certains patients. Cependant, tous ne réagissent pas de la même manière. Pourquoi ? Une réponse se dessine de plus en plus clairement grâce à des équipes de l’AP-HP, de l’INRA, de Gustave Roussy et de l’Inserm.
Ces chercheurs révèlent que la composition du microbiote intestinal pourrait être la clé pour prédire la réponse des patients aux immunothérapies [1].
Leur étude clinique menée chez 26 patients atteints de mélanome avec métastases et traités par l’ipilimumab (Yervoy de Bristol Myers Squibb), un anticorps monoclonal, montre qu’une modification ciblée du microbiote intestinal pourrait améliorer significativement l’efficacité du traitement.
Ces résultats ont été publiés dans *Annals of Oncology* et marquent un nouveau tournant vers la personnalisation du traitement des cancers.
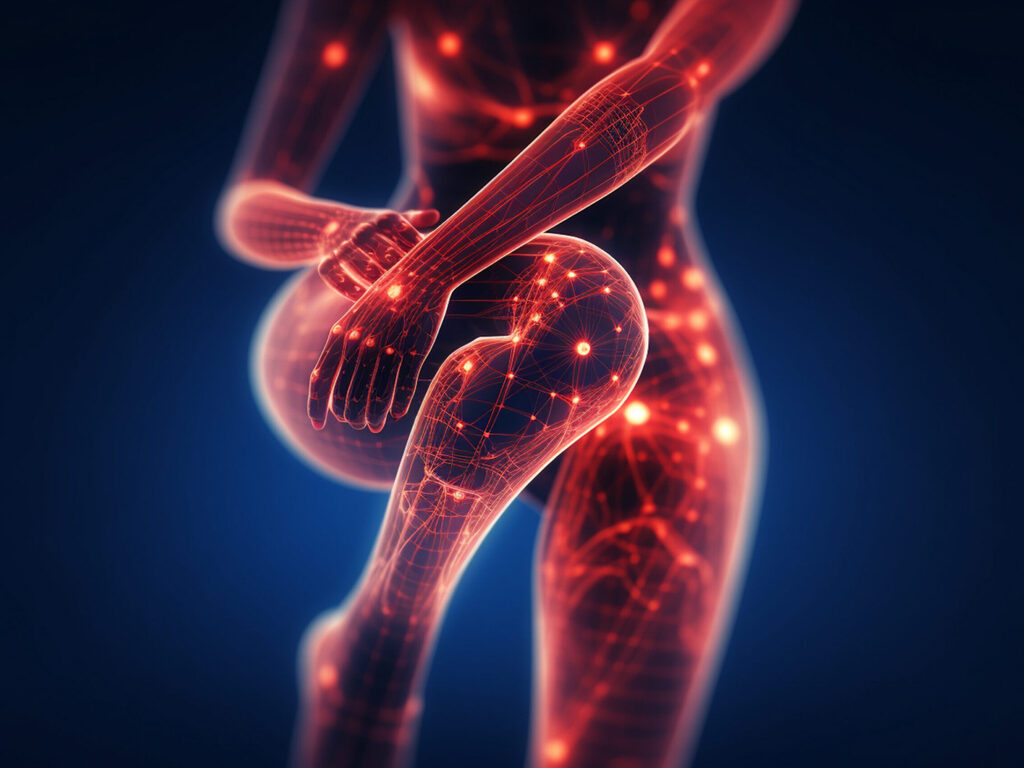
Le microbiote intestinal, composé de plus de 100 000 milliards de bactéries, joue un rôle essentiel dans le développement et l’équilibre de notre système immunitaire. Ces recherches, en plein essor, démontrent combien cette multitude de bactéries influence non seulement la digestion, l’absorption des nutriments et plus loin dans le colon l’entretien des bactéries, mais aussi notre capacité à répondre à des traitements aussi complexes que l’immunothérapie.
Le Pr Franck Carbonnel de l’hôpital Bicêtre, AP-HP, le Dr Patricia Lepage de l’INRA, ainsi que les Prs Caroline Robert et Nathalie Chaput de Gustave Roussy, ont montré que le microbiote pouvait aider à distinguer les patients répondeurs des non-répondeurs à l’immunothérapie, et que son ajustement pourrait transformer la réponse thérapeutique.
Ces études, que l’on pourrait penser réservées aux seuls spécialistes, s’inscrivent en réalité dans un cadre plus large. En effet, elles rejoignent un ensemble de travaux, récents et fascinants, qui pointent vers le rôle crucial du microbiote dans le traitement des cancers. Par exemple, il est désormais reconnu que certaines espèces bactériennes favorisent une meilleure réponse aux inhibiteurs de points de contrôle immunitaires (ICI), un type d’immunothérapie qui a profondément modifié le pronostic de nombreux patients [2, 3].
Cependant, soyons précis et prudent, l’action du microbiote est double : il peut à la fois renforcer l’immunité antitumorale ou, au contraire, l’inhiber. C’est pourquoi il doit être considéré avec prudence et comme un « allié complexe » dans notre lutte contre la maladie.
Une étude récente a montré qu’une plus grande diversité du microbiote intestinal est associée à une meilleure réponse à ces traitements.
Chez les patients atteints de cancer du poumon non à petites cellules, ceux présentant une flore intestinale plus riche en *Faecalibacterium* ont démontré une meilleure réponse aux traitements d’immunothérapie, accompagnée d’une production accrue d’acides gras à chaîne courte (AGCC) tels que le butanoïque, l’acétique et l’hexanoïque [3].
Ces AGCC, dérivés, fabriqués par le microbiote, jouent un rôle crucial dans la régulation des cellules immunitaires et semblent également influencer l’efficacité des traitements contre le cancer en particulier du colon et du rectum.
Mais ce n’est pas tout ! Les recherches récentes ont également mis en lumière un phénomène fascinant : les patients plus âgés semblent mieux réagir aux immunothérapies [2].
En analysant des données de séquençage unicellulaire, nous avons observé une activation plus marquée des cellules lymphocytes T épuisées et cytotoxiques dans le microenvironnement tumoral des patients âgés. Un lien avec le microbiote ? Très certainement ! En effet, un type spécifique de microbiote, enrichi avec l’âge, semble jouer un rôle protecteur et pourrait expliquer cette sensibilité accrue.
Des expériences de transplantation fécale chez des souris ont confirmé ces hypothèses : en transplantant ce microbiote « enrichi », les souris deviennent plus sensibles aux traitements, leur microenvironnement tumoral se modifie favorablement [2].
Faudra-t-il faire de même chez l’humain ? La question se pose.
Ces découvertes ouvrent une voie encourageante vers une médecine plus individualisée, adaptée aux particularités de chacun. Si nous pouvons ajuster la composition du microbiote pour améliorer la réponse aux traitements, nous franchirons une étape décisive dans la lutte contre le cancer.
Surtout, il est indispensable déjà de tout faire pour relier nos habitudes alimentaires à la qualité santé du microbiote.
Chers amis, nous suivons ces développements de près.
Retenez que notre santé est intrinsèquement liée à notre alimentation et à l’équilibre de notre microbiote. Cette médecine de l’avenir, fondée sur des approches naturelles et personnalisées, rejoint ce que nous prônons depuis longtemps : une santé holistique, où la prévention et la prise en charge globale de l’individu priment.
Bien à vous toutes et à vos familles,
Professeur Joyeux
**Références :**
- Chaput, P., Lepage, P., Coutzac, C., et al. *Baseline gut microbiota predicts clinical response and colitis in metastatic melanoma patients treated with ipilimumab.* Annals of Oncology, mai 2017.
- Zhu X, Huang X, Hu M, et al. *A specific enterotype derived from gut microbiome of older individuals enables favorable responses to immune checkpoint blockade therapy.* Cell Host Microbe. 2024;32(4):489-505.e5. [PMID: 38513657](https://pubmed.ncbi.nlm.nih.gov/38513657/)
- Ren S, Feng L, Liu H, et al. *Gut microbiome affects the response to immunotherapy in non-small cell lung cancer.* Thorac Cancer. 2024;15(14):1149-1163. [PMID: 38572783](https://pubmed.ncbi.nlm.nih.gov/38572783/)
- Wang J, Zhu N, Su X, et al. *Gut microbiota: A double-edged sword in immune checkpoint blockade immunotherapy against tumors.* Cancer Lett. 2024;582:216582. [PMID: 38065401](https://pubmed.ncbi.nlm.nih.gov/38065401/)
Partager cette lettre
S’abonner aux lettres gratuitement
Luc Montagnier a découvert en 1983 le virus du sida (VIH, Virus de l’Immunodéficience Humaine). Il a très vite compris qu’un vaccin contre ce retrovirus à ARN, serait très difficile à mettre au point du fait de ses mutations permanentes. Quarante plus tard le vaccin n’existe toujours pas.